المعادلة الكيميائية الموزونة اللفظية والرمزية
المعادلة الكيميائية الموزونة اللفظية والرمزية، التفاعل الكيميائي هو عملية يتم فيها تحويل مادة أو أكثر (المتفاعلات)، إلى مادة أو أكثر (النواتج)، والمواد هي إما أن تكون عناصر أو مركبات كيميائية.
ويقوم التفاعل الكيميائي بإعادة ترتيب الذرات المكونة للمواد المتفاعلة لتكوين مواد مختلفة كمنتجات، تابعوا موقع مقال للتعرف على المعادلة الكيميائية الموزونة اللفظية والرمزية.
المقصود بالمعادلة الكيميائية
هي عبارة عن التمثيل الرمزي لتفاعل كيميائي في شكل رموز وصيغ، حيث يتم وضع المواد المتفاعلة (المتفاعلات) على الجانب الأيسر من المعادلة، والمواد الناتجة (النواتج) تضع على الجانب الأيمن منها.
والمعاملات التي تكون بجانب كل رمز وصيغ المواد هي القيم المطلقة للأرقام المتكافئة.
بينما تشير يتم الإشارة إلى حالة كل مادة متفاعلة أو ناتجة من خلال رموز معينة تفيد معنى هذه الحالة (s,g,l,aq).
وتوضع بداخل أقواس أسفل أو أيمن المواد المتفاعلة والناتجة.

شاهد أيضًا: بحث كامل عن الحسابات الكيميائية والمعادلات الكيميائية
المعادلة الكيميائية اللفظية والرمزية
يتم وصف التفاعل الكيميائي بعدة طرق مختلفة من خلال الكيميائيين، ومن هذه الطرق، ما يلي:
يمكنهم رسم صورة للتفاعل الكيميائي كالتالي:
يمكنهم وصف التفاعل لفظيًا فقط، أو على شكل معادلة كيميائية لفظية
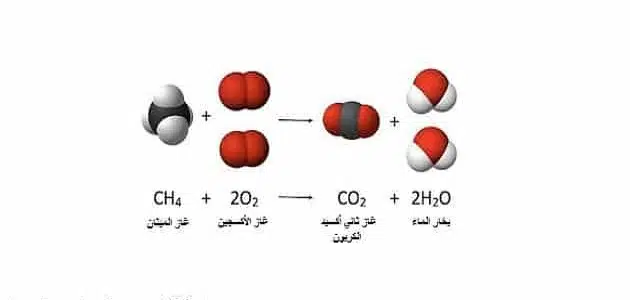
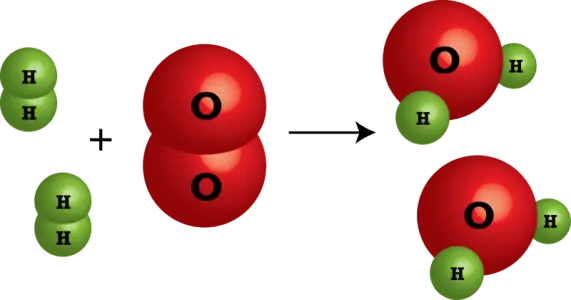
ففي هذا المثال يوصف التفاعل لفظيًا فيقال: يتفاعل جزئيان من غاز الهيدروجين مع جزيء واحد من غاز الأكسجين لإنتاج جزيئين من بخار الماء.
أما صورته على شكل معادلة كيميائية لفظية يكون على النحو التالي:
جزئيان من غاز الهيدروجين + جزيء من غاز الأكسجين ← جزئيان من بخار الماء
يمكنهم كتابة التفاعل في شكل معادلة كيميائية رمزية، كالآتي:
(2H2(g) + O2(g) → 2H2O(g
وفي المعادلة الكيميائية الرمزية، يتم استخدام الرموز الكيميائية بدلاً من الأسماء.
وتستخدم الرموز الأخرى للإشارة إلى حالة كل مادة، ويجب أن يكون واضحًا أن هذه هي الطريقة الأسرع والأكثر وضوحًا لوصف تفاعل كيميائي.
المتفاعلات والنواتج في المعادلة الكيميائية
من أجل وصف تفاعل كيميائي، نحتاج إلى توضيح المواد الموجودة في بداية التفاعل الكيميائي، والمواد الموجودة في نهاية نفس التفاعل الكيميائي.
وتسمى المواد الموجودة في بداية التفاعل الكيميائي بالمواد المتفاعلة (المتفاعلات)، بينما تسمى المواد الموجودة في نهاية التفاعل الكيميائي بالمواد الناتجة (النواتج).
المعادلة العامة للتفاعل هي: “المواد المتفاعلة (المتفاعلات) ← المواد الناتجة (النواتج)”؛ لنلقي نظرة على مثال.
مثال: عند إضافة ثاني أكسيد الكبريت (SO2) إلى الأكسجين (O2)، يتم إنتاج ثالث أكسيد الكبريت (SO3).
وفي هذا التفاعل الكيميائي يكون كلاً من ثاني أكسيد الكبريت، والأكسجين ( SO2 + O2 ) متفاعلات، بينما ثالث أكسيد الكبريت (SO3) هو الناتج.
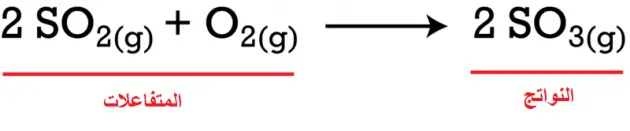
تحويل المعادلات الكيميائية اللفظية إلى رمزية والعكس
من المهم أن تكون قادرًا على الترجمة بين الأوصاف المكتوبة للتفاعلات، والمعادلات الكيميائية.
ترجمة المعادلة الكيميائية اللفظية إلى معادلة كيميائية رمزية
مثال: عند إضافة محلول مائي من نترات الكالسيوم إلى محلول مائي من هيدروكسيد الصوديوم لإنتاج هيدروكسيد الكالسيوم الصلب ومحلول مائي من نترات الصوديوم.
فإن المعادلة الكيميائية الرمزية الموزونة المقابلة لهذه المعادلة اللفظية، هي:
(Ca(NO3)2(aq)+2 NaOH(aq)→Ca(OH)2(s)+2 NaNO3(aq
الآن دعونا نجرب العكس.
ترجمة المعادلات الكيميائية الرمزية إلى معادلة كيميائية لفظية
مثال: ضع في اعتبارك المعادلة التالية:
(Cu(s)+AgNO3(aq)→Cu(NO3)2(aq)+Ag(s
فإن الوصف اللفظي لهذا التفاعل يقرأ كالآتي: يتفاعل النحاس الصلب مع محلول مائي من نترات الفضة، لإنتاج الفضة الصلبة ومحلول مائي من نترات النحاس (II).
- بالإضافة إلى الصيغ الكيميائية للمواد المتفاعلة والناتجة، هناك بعض الرموز، التي نحتاج إلى معرفتها للتواصل باستخدام المعادلات الكيميائية.
الرموز الأكثر استخدامًا في المعادلة الكيميائية
- يستخدم الرمز ” → “ لفصل المواد المتفاعلة عن المواد الناتجة.
- كما يستخدم المز ” + “ لفصل المواد المتفاعلة عن بعضها البعض وكذلك لفصل المواد الناتجة عن بعضها البعض.
- يستخدم الرمز ” (s) “ للإشارة إلى وجود العنصر أو المركب في الحالة الصلبة.
- أيضًا يستخدم الرمز ” (l) “ للإشارة إلى وجود العنصر أو المركب في الحالة السائلة.
- يستخدم الرمز ” (g) “ للإشارة إلى وجود العنصر أو المركب في الحالة الغازية.
- كذلك يستخدم الرمز ” (aq) “ للإشارة إلى وجود العنصر أو المركب في الحالة المائية.
تابع أيضًا: بحث عن المعادلات الكيميائية الحرارية
وزن (موازنة) المعادلات الكيميائية
على الرغم من تكسير المركبات الكيميائية وتكوين مركبات جديدة أثناء التفاعل الكيميائي، لا يتم أبدًا تكوين الذرات الفردية أو تدميرها.
وفي نفس الذرات التي كانت موجودة في المواد المتفاعلة موجودة في المنتجات، يتم إعادة تنظيمها فقط في ترتيبات مختلفة.
وفي المعادلة الكيميائية الكاملة، يجب موازنة طرفي المعادلة، أي، في المعادلة الكيميائية الكاملة، يجب أن يكون نفس العدد من كل ذرة موجودًا على كل جانب من جوانب المعادلة.
من المهم جدًا ملاحظة أنه يجب تنفيذ هذه الخطوات بالترتيب الصحيح، ويجب أن يكون لديك الصيغ الصحيحة للمواد المتفاعلة والمنتجات قبل أن تتمكن من استخدام المعاملات لموازنة المعادلة.
هناك نوعان من الأرقام التي تظهر في المعادلات الكيميائية، حيث أن هناك رموز فرعية، وهي جزء من الصيغ الكيميائية للمواد المتفاعلة والمنتجات.
وهناك معاملات موضوعة أمام الصيغ للإشارة إلى عدد جزيئات تلك المادة المستخدمة أو المنتجة.
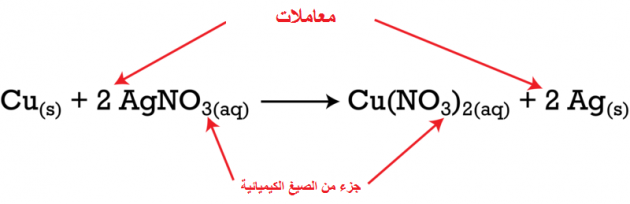
تعد الرموز الفرعية جزءًا من الصيغ، وبمجرد تحديد الصيغ الخاصة بالمواد المتفاعلة والناتجة، قد لا يتم تغيير الرموز الفرعية.
وتشير المعاملات إلى عدد كل مادة متضمنة في التفاعل، ويمكن تغييرها من أجل موازنة المعادلة.
وتشير المعادلة أعلاه إلى أن مولًا واحدًا من النحاس الصلب يتفاعل مع مولين من نترات الفضة المائية لإنتاج مول واحد من نترات النحاس المائي (II) ومولان من الفضة الصلبة.
كتابة الصيغ الكيميائية
عندما تتعلم كيفية كتابة الصيغ الكيميائية، يتم توضيح أنه عند وجود ذرة واحدة فقط من عنصر ما، لا تتم كتابة الرمز “1”.
وعندما لا يظهر رمز منخفض للذرة في الصيغة، فإنك تقرأ ذلك على أنه ذرة واحدة، وينطبق الشيء نفسه في كتابة المعادلات الكيميائية المتوازنة.
فإذا تم تضمين ذرة واحدة أو جزيء واحد في التفاعل، يتم حذف المعامل “1”.
ويتم إدخال المعاملات في المعادلة الكيميائية لموازنتها، مما يجعل العدد الإجمالي لكل ذرة على جانبي المعادلة متساويًا.
كما يتم تحقيق موازنة المعادلات عن طريق تغيير المعاملات، وليس عن طريق تغيير الرموز.
وتتضمن عملية كتابة معادلة كيميائية متوازنة ثلاث خطوات.
- الخطوة الأولى: تحديد المواد المتفاعلة والناتجة.
- أيضًا الخطوة الثانية: كتابة الصيغ لجميع المواد المتفاعلة والناتجة، وكن حذرًا بشأن العناصر ثنائية الذرة، وتذكر أن الرموز المنخفضة للمركب الأيوني تُستخدم لموازنة الشحنة.
- كذلك الخطوة الثالثة: ضبط المعاملات لموازنة المعادلة.
مثال: اكتب معادلة متوازنة للتفاعل الذي يحدث بين غاز الكلور وبروميد الصوديوم المائي، لإنتاج البروم السائل وكلوريد الصوديوم المائي.
الحل:
- الخطوة الأولى: نكتب المعادلة لفظيًا مع الأخذ في الاعتبار أن الكلور والبروم يشيران إلى الجزيئات ثنائية الذرة، وهذا كالتالي:
كلور + بروميد الصوديوم ← بروم + كلوريد الصوديوم
- الخطوة الثانية: نستبدل الصيغ الصحيحة في المعادلة، وهذا كالتالي:
Cl2+NaBr→Br2+NaCl
- الخطوة الثالثة: ندخل المعاملات عند الضرورة لموازنة المعادلة، حيث أنه من خلال وضع معامل 2 أمام (NaBr).
- يمكننا موازنة ذرات البروم، وبوضع معامل 2 أمام (NaCl)، يمكننا موازنة ذرات الكلوريد، وهذا كالتالي:
Cl2+2 NaBr→Br2+2 NaCl
ويُظهر الفحص النهائي (افعل هذا دائمًا) أن لدينا نفس عدد كل ذرة على جانبي المعادلة، لذا فإن هذه المعادلة متوازنة بشكل صحيح.
اخترنا لك: العدد الذري والكتلي للعناصر الكيميائية
في نهاية مقال المعادلة الكيميائية الموزونة اللفظية والرمزية، قدمنا لكم المعادلات الكيميائية اللفظية والرمزية الموزونة، وكيفية التحويل بين كلٍ منهما، فنرجو أن يكون المقال أفدكم ونال استحسانكم، وللمزيد من المواضيع التثقيفية، زوروا موقع مقال!